Accueil du site > Evènements > Comptes rendus > 3ème symposium du CICBAA : 29 et 30 septembre 2005 - Dr Geneviève DEMONET

3ème symposium du CICBAA : 29 et 30 septembre 2005 - Dr Geneviève DEMONET
vendredi 30 septembre 2005, par
L’arachide au travers de la biologie et des recombinants, ainsi que la rare allergie au soja contenu dans des laits infantiles recommandés chez les allergiques, les isolats de blé et l’allergie alimentaire induite par l’effort ont été les sujets de l’après-midi du premier jour. Le vendredi après-midi : Le risque allergique des protéines alimentaires dans les préparations médicamenteuses pour soins topiques cutanés et dans les cosmétiques ; sensibilisation percutanée aux protéines ; Atopie patch-tests et IgE : état de la question.
IgE spécifiques aux protéines d’arachide et mise en relation avec les manifestations cliniques.
L.Mondoulet
Le travail présenté concerne la réponse IgE contre un répertoire assez large et représentatif des protéines de l’arachide chez 68 patients allergiques à l’arachide.
– 79% de ces patients (âgés en moyenne de 6 ans) présentaient une dermatite atopique.
– L’allergie à l’arachide avait été confirmée par des tests cutanés et des TPO.
L’extraction, la purification et l’identification des protéines de la graine d’arachide a permis l’obtention d’une vingtaine de protéines appartenant aux principales protéines de réserve de plantes à savoir les globulines 7S (Ara h 1) et 11S (Ara h 3) et les albumines 2S (Ara h 2, Ara h 6).
Les tests enzymo-immunologiques (EAST) ont montré que toutes les protéines isolées et purifiées sont reconnues par les IgE de plus de 60% des patients.
Chaque patient manifeste une polysensibilisation avec des IgE dirigées contre plusieurs des allergènes étudiés.
Les moyennes des réponses IgE spécifiques les plus fortes ont été observées chez les patients ayant une allergie sévère et cela aussi bien pour l’arachide brute que pour les allergènes isolés.
Ces résultats ont été retrouvés avec les tests cutanés réalisés avec les allergènes purifiés.
Pour l’instant, pas de retombée pratique : les allergènes purifiés n’ont pas de supériorité par rapport à l’arachide brute...
Profil de reconnaissance cutanée et biologique des allergènes recombinants majeurs de l’arachide chez les patients allergiques
G.Kanny
Un exposé complémentaire au précédent qui pourrait, à première vue, être aussi contradictoire...
Des allergènes recombinants d’arachide (Ara h 1, Ara h 2, Ara h 3 et Ara h 4) ont été fabriqués puis testés chez 30 patients allergiques à l’arachide.
Un groupe témoin de 15 sujets non atopiques et de 15 autres sensibilisés au pollen de bouleau a également été testé.
Ont été étudiés à la fois les IgE spécifiques et les prick-tests cutanés.
Le profil de sensibilisation était de 40% pour Ara h 1, de 100% pour Ara h 2, de 23% pour Ara h 3 et de 17% pour Ara h 4.
Une corrélation entre gravité de l’allergie et taille des tests cutanés aussi bien que taux des IgE spécifiques n’a pas été établie.
Par contre, les patients monosensiblisés (Ara h 2) avaient une allergie moins sévère que ceux qui étaient polysensibilisés.
Malgré la petite taille de cette étude, les résultats sont prometteurs. Si ces résultats sont confirmés, les allergènes recombinants majeurs de l’arachide pourraient être utilisés dans l’avenir pour apprécier la probabilité de sévérité de la pathologie et peut-être pour une immunothérapie spécifique.
Il n’y a pas de glycosylation pour les allergènes recombinants (contrairement aux allergènes purifiés), ce qui pourrait expliquer les différences de résultats entre les allergènes purifiés et les allergènes recombinants.
Allergie au Neocate®, substitut à base d’acides aminés : la présence de protéines de soja est incriminée
M.MORISSET
La prise en charge des allergies aux protéines de lait de vache repose sur l’utilisation d’hydrolysats de protéines de lait. Cependant, des réactions allergiques à ces substituts sont possibles conduisant à l’utilisation de formules à base d’acides aminés (FAA).
Deux cas seulement d’allergie à un FAA ont été rapportés jusqu’ici dans la littérature : le premier a finalement été relié à une contamination par du lait, pour le deuxième, la responsabilité d’une huile de soja.a été avancée.
M. Morisset rapporte ici le cas de 10 enfants, vus entre 2001 et 2005 pour allergie alimentaire multiple, âgés de 4 à 15 mois, présentant dermatite atopique sévère, troubles digestifs (6 cas) et urticaire et angio-œdème (un cas).
Devant la persistance des symptômes, le remplacement du substitut au lait avait été fait avec du Neocate sans amélioration.
Des prick-in-prick tests (PIP) à la farine de soja et des patch-tests d’atopie (APT) au soja et au Neocate ont été réalisés.
Les PIP se sont avérés positifs chez 2 patients sur 7, les APT au soja chez 6 patients sur 6 et les APT au Neocate chez 4 nourrissons sur 6.
4 TPO ont été réalisés (1 en ouvert, 3 en double aveugle). On peut noter qu’un des patients n’a réagit qu’au 6ème jour...
Une extraction des protéines a été réalisée a partir de l’émulsion lipidique de soja. La teneur en protéine est de 0,34 ± 0,2 mg/l.
Le Neocate a été remplacé chez ces enfants par le Neocate advance qui ne contient pas d’huile de soja mais qui est un lait 2ème âge.
Le choix et la qualité des huiles végétales, supports des FAA, devrait donc être rediscutés même si le nombre de cas d’allergie est restreint.
Néoallergénicité des isolats de blé : une allergie alimentaire en progression
F.Battais
Les isolats de blé résultent de la désamidation de la fraction de gluten de la farine de blé. Cette désamidation provoque des modifications de la structure primaire et secondaire des protéines de gluten entraînant l’apparition de néo-allergènes (non présents dans les protéines natives de la farine de blé).
Les isolats de blé sont utilisés pour leurs propriétés émulsifiantes, gélifiantes et stabilisantes. On les retrouve dans des aliments industriels (viande, charcuterie...).
F. Battais a exposé un travail effectué sur une série de 27 patients ayant présenté une allergie aux isolats de blé (urticaire le plus souvent). Tous ces patients consomment de la farine de blé sans inconvénient.
La réactivité des IgE spécifiques de chaque patient vis-à-vis des différentes fractions de la farine de blé ainsi que vis-à-vis d’un extrait d’isolat de blé a été étudiée par EAST direct.
Les allergènes reconnus par les IgE des sérums des patients allergiques ont été identifiés dans la fraction gamma et omega 12 de la gliadine avec un épitope unique.
L’augmentation du nombre de cas depuis 5 ans, la gravité des réactions allergiques induites par ces isolats de blé et l’utilisation importante de ces ingrédients alimentaires soulignent l’importance d’un étiquetage précis.
Si on n’a pas encore la possibilité de demander un dosage d’IgE spécifiques pour les isolats de blé, l’extrait pour prick-test est par contre disponible.
Une allergie nouvelle à ne pas méconnaître !
Diagnostic de l’anaphylaxie alimentaire induite par l’effort
E. Beaudouin
L’anaphylaxie alimentaire induite par l’effort (AAIE) est un sous-groupe d’une entité plus large : l’anaphylaxie induite par l’exercice (AIE).
Le premier cas d’AAIE a été décrit en 1979.
L’intervalle entre la prise alimentaire et les symptômes est en général de 30 minutes à 2 heures (cependant le délai peut être plus long : une réaction a été décrite 20 heures après l’ingestion de crevette chez un marathonien...).
Le délai de survenue des symptômes par rapport au début de l’effort varie de 10 minutes à plus d’une heure.
Le jogging, la marche, l’aérobic sont les activités sportives les plus souvent en cause alors que le vélo, le ski, la natation sont plus rarement concernés.
La farine de blé et les fruits de mer sont les 2 allergènes les plus fréquemment en cause (les crevettes chez les plus jeunes et le blé chez les plus âgés). Pêche, raisin, céleri, tomate, pomme de terre, poulet, escargot...ont également été incriminés.
Des facteurs favorisants sont décrits : stress, règles et surtout prise concomitante d’aspirine ou d’AINS (parfois même la consommation de l’aliment seul ne déclenche pas de réaction : il faut l’association de l’aliment, de l’aspirine et de l’effort).
Parfois, l’ingestion simultanée de 2 aliments a été décrite comme nécessaire pour l’apparition des symptômes.
Il faut différencier l’AAIE de l’urticaire cholinergique, d’un asthme induit par l’exercice, d’une allergie alimentaire aggravée par l’effort, d’une mastocytose, d’une hypoglycémie ou d’un malaise vaso-vagal.
La démarche diagnostique repose sur l’interrogatoire, le dosage des IgE spécifiques, la pratique de tests cutanés et enfin de tests de provocation (en milieu hospitalier).
Ceux-ci doivent être réalisés en 3 étapes : TPO avec l’aliment seul le premier jour, exercice seul le jour suivant et prise alimentaire suivie d’un exercice sur tapis roulant (et pas sur vélo...) dans les 30 à 90 minutes suivantes.
Il faut que la quantité d’aliment ingéré soit suffisamment importante. C’est un des facteurs qui pourrait expliquer la mauvaise reproductibilité des tests de provocation.
Si une réaction IgE dépendante est établie, les mécanismes physiopathologiques de l’AAIE restent cependant incertains : abaissement du seuil d’activation des basophiles et des mastocytes par l’exercice, aggravation de cette dégranulation par les endorphines et la gastrine libérés lors de l’exercice, hyperperméabilité intestinale, activation de la transglutaminase par l’effort pour le blé...
Quelle conduite à tenir chez les patients présentant une AAIE ? : 4 à 5 heures de jeûne avant l’exercice ; pas de bêtabloquant, d’IEC, d’aspirine ou d’AINS, et pour finir, avoir de l’adrénaline...
Le risque allergique des protéines alimentaires dans les préparations médicamenteuses pour soins topiques cutanés et dans les cosmétiques
F. Codréanu
L’utilisation des protéines dans les cosmétiques et les topiques médicamenteux est courante.
La nomenclature internationale des ingrédients des produits cosmétiques (INCI) établie en 2003 par la communauté européenne permet de répertorier 240 protéines. Certaines sont d’origine végétale (arachide, lupin, soja, blé et ses hydrolysats, avoine, sésame), d’autres animales (œuf, lait de vache, caséine, extraits de poisson).
De nombreuses huiles sont également utilisées en cosmétique notamment l’huile d’arachide, de fruits à coques, de sésame, de germes de blé...
Pour les médicaments, la liste des excipients à effet notoire publiée au Journal officiel permet de retrouver des protéines alimentaires : amidon de blé, huile d’arachide, soja, sésame, protéines de lait contaminant le lactose.
Deux types de réactions sont possibles en cas d’allergie à des protéines appliquées sur la peau : des réactions d’hypersensibilité immédiates (urticaire de contact et exceptionnellement choc anaphylactique) et des réactions d’hypersensibilité retardée.
La sensibilisation aux protéines alimentaires survient préférentiellement chez les sujets atopiques et peut être suivie secondairement d’une allergie alimentaire secondaire. Cela a été prouvé pour l’arachide, l’hypothèse est posée pour les autres protéines.
Cette sensibilisation pourrait être favorisée par une dermatite atopique et le jeune âge.
Un inventaire des réactions allergiques aux protéines alimentaires contenues dans les cosmétiques et les topiques médicamenteux a été présenté à la fois dans la littérature et dans l’expérience personnelle de l’intervenant : on retrouve
– le blé (amidon de blé dans le bain, crème anti-rides, gel douche, mascara),
– les hydrolysats de blé,
– l’avoine (Dermalibour, crème Exoméga),
– le lait de vache (savon Saugella, baume gingival),
– le sésame (fond de teint),
– l’huile d’arachide (Brochodermine),
– l’œuf (shampooing).
Aucun cas n’a été décrit pour l’instant avec le lupin.
Que peut-on faire en pratique ?
– Chez l’adulte présentant une allergie alimentaire, il faut éviter l’utilisation de topiques contenant cet allergène.
– Chez l’enfant, il faut éviter l’utilisation de topiques contenant des protéines alimentaires pour éviter une sensibilisation ultérieure.
– Cependant, ces mesures sont rendues difficiles par la nomenclature INCI qui n’est pas toujours claire pour les parents (pas toujours facile de reconnaître le blé sous l’appellation Triticum vulgare...).
Sensibilisation percutanée aux protéines
J-F Nicolas
La sensibilisation par voie cutanée est-elle possible ? Quels sont les modes d’expression de l’allergie cutanée aux protéines chez un individu sensibilisé ?
(Ce sujet a déjà été traité par J-F Nicolas lors du symposium Allerbio à la SFAIC à Montpellier).
On peut rappeler que la pénétration des protéines est favorisée par l’utilisation concomitante de liposomes, d’éthanol, de polyéthylène glycol, d’acide linoléique, de limonème, de détergeant (sodium lauryl sulfate...) mais également par l’exposition aux UV.
Dans la dermatite atopique, la barrière cutanée est altérée en raison d’une baisse de l’hydratation cutanée. Des anomalies lipidiques sont également incriminées (déficit en céramides). L’inflammation pourrait également entraîner une altération de la barrière cutanée.
Cependant, l’eczéma obtenu après sensibilisation au nickel n’entraîne pas d’altération de la perméabilité cutanée contrairement au résultat obtenu avec un allergène protéique (acarien par exemple). L’activité enzymatique des protéines serait ici en cause.
La plupart du temps, la pénétration d’une protéine s’accompagne d’un phénomène de tolérance. Les faibles doses induiraient plutôt une tolérance alors que les fortes conduiraient à une immunisation.
L’exposition d’un patient allergique à des protéines sur la peau va provoquer urticaire de contact (essentiellement professionnelle), dermatite de contact aux protéines (HSI et HSR), dermatite atopique extrinsèque (HSI et HSR) (beaucoup de travaux suggèrent que la dermatite atopique n’est rien d’autre qu’une dermatite de contact aux protéines...) voire exceptionnellement anaphylaxie systémique.
L’exploration allergologique s’aidera de prick-tests, d’open tests, du dosage des IgE spécifiques dans les réactions d’hypersensibilité immédiate et de patch-tests, open tests dans les réactions d’hypersensibilité retardée.
En pratique, il faut protéger la couche cornée de l’abrasion (pas de lavages intempestifs, haro sur les lingettes pour bébé...) et restaurer la barrière cutanée par l’utilisation d’émollients (sans protéines alimentaires bien sûr !).
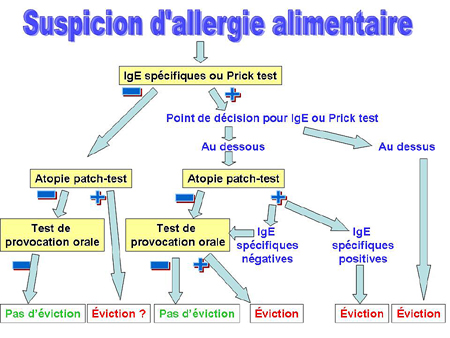
Atopie patch-tests et IgE : état de la question
B. Niggeman
Une communication intéressante qui tente d’avancer sur le diagnostic de l’allergie alimentaire en comparant les atopie patch-tests, les IgE spécifiques et les prick-tests cutanés, séparément mais aussi de façon associée, ce qui est nouveau.
La première publication de Sampson, sur le seuil d’IgE spécifiques permettant d’établir un diagnostic positif d’allergie alimentaire avec une certitude de 95%, date de 1997 (15 kU/l pour la cacahuète). Depuis, plusieurs études se sont succédées avec des résultats différents.
Cette diversité peut être expliquée par les nombreuses variables entre les travaux :
– population étudiée différente (dermatite atopique ou autre, âge des patients),
– réactions cliniques précoces ou tardives,
– preuve de l’allergie alimentaire (uniquement histoire clinique ou TPO en double aveugle contre placebo),
– durée de la maladie (de 3 mois à 10 ans),
– utilisation de la même technique ou non (Pharmacia CAP System ou autre),
– détermination du seuil de diagnostic.
B. Niggeman a rapporté les résultats d’une étude sur 501 patients présentant une dermatite atopique âgés de 1 mois à 16,1 ans.
– Une valeur seuil de 12,6 kU/l avec une probabilité de 95% a été retrouvée pour l’œuf.
– Elle était de 59,2 kU/l pour une probabilité de 99%.
– Aucun point de décision n’a pu être déterminé pour le lait de vache, le blé et le soja.
– Aucune différence n’a été retrouvée entre le taux d’IgE spécifique isolé et le rapport IgE spécifiques sur IgE totales.
– En ce qui concerne les prick-tests cutanés (PTC), une valeur seuil de 13 mm pour une probabilité de 95% et de 18,3 mm pour une probabilité de 99% a été retrouvée pour l’œuf.
– Aucune différence n’a été retrouvée entre l’utilisation du diamètre de la papule pris isolément et le rapport papule sur témoin.
– En réalité, il faut relativiser l’intérêt de ces valeurs seuils car très peu d’enfants rentrent dans le cadre (3% par exemple vont bénéficier des valeurs seuils pour les tests cutanés et peuvent faire l’économie du TPO).
Si les prick-tests cutanés et le dosage des IgE spécifiques sont associés aux réactions immédiates, les réactions tardives sont mieux explorées par les atopie-patch tests (ATP).
Dans une étude récente, l’orateur a démontré que les APT représentaient le meilleur test prédictif pour une probabilité de 95% pour l’évaluation de l’allergie au lait de vache.
Cependant, la meilleure spécificité va être obtenue en combinant plusieurs tests : 2 sont suffisants : ATP et PTC ou bien ATP et taux d’IgE spécifique défini (supérieur à 0,35 kU/l pour le lait de vache et supérieur à 17,5 kU/l pour l’œuf).
La meilleure combinaison semble être APT et PTC même si la spécificité n’est quand même pas non plus de 100%.
On augmente ainsi la proportion d’enfants concernés à 4 ou 7% ce qui est peu mais mieux qu’avec un seul test.
Nous n’avons cependant pas encore de données pour plusieurs aliments.
Comment faire ces ATP en pratique ?
– Ce sont des tests épicutanés pratiqués avec des allergènes de type immédiat, les aliments dans le cas présent.
– Ils doivent être posés sur une peau saine, habituellement sur le dos des patients.
– Des cupules en aluminium de 12 mm sont utilisées (Finn Chambers on Scanpor par exemple).
– Il faut préférer les aliments natifs : une goutte de lait de vache, d’œuf natif, de poudre de blé dissoute dans l’eau, de lait de soja est disposée sur le papier filtre.
– Le temps d’occlusion est de 48 heures. Une première lecture est faite 20 minutes après avoir enlevé les tests puis à 72 heures.
– La réaction allergique est lente, va en augmentant, est persistante, avec une marge irrégulière, un érythème et des papules. Il faut la différencier d’une réaction irritative.
– La question reste cependant posée d’une possibilité de sensibilisation active par l’APT.
– Il faut pour cela respecter les indications du test et de ne pas les répéter.
En conclusion, un arbre de décision en cas de suspicion d’allergie alimentaire a été proposé :