Accueil du site > Maladies > Atopie > SEIPA pour moi, mais c’est pour qui ? Y a t il des prédispositions (…)

SEIPA pour moi, mais c’est pour qui ? Y a t il des prédispositions génétiques au SEIPA ?
lundi 25 novembre 2024, par
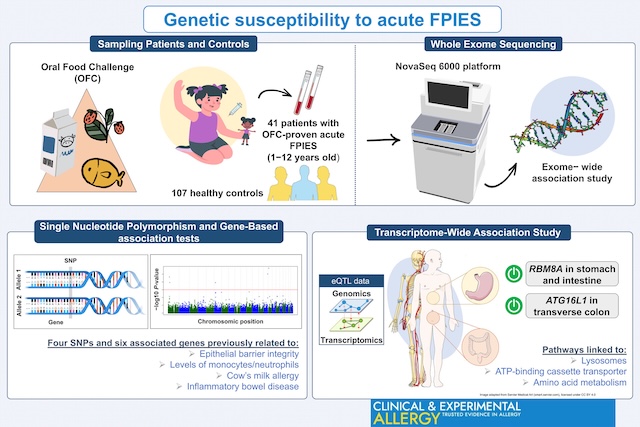
Le syndrome d’entérocolite induit par les protéines alimentaires (SEIPA) est une forme d’allergie alimentaire qui touche principalement les nourrissons, conduisant souvent à des vomissements et à des chocs. En raison de sa physiopathologie mal comprise et de l’absence de biomarqueurs spécifiques, le diagnostic est souvent retardé. Comprendre la génétique des SEIPA (FPIES pour les anglo-saxon pour food protein-induced enterocolitis syndrome) peut faire la lumière sur la sensibilité à la maladie et la physiopathologie, clé pour développer des stratégies diagnostiques, pronostiques, préventives et thérapeutiques. En utilisant une cohorte bien caractérisée de patients, les auteurs explorent les facteurs de susceptibilité potentiels du génome sous-jacents au SEIPA/FPIES.
Méthode
Des échantillons de sang de 41 patients atteints de FPIES à provocation orale, qui ont été prouvés par des tests de provocation oraux (TPO) en Espagne et en Italie, ont été collectés dans le cadre d’une étude complète sur l’association de séquençage des exomes. La cohorte de patients était composée de 41 enfants âgés de 1 à 12 ans et d’un adulte. Des échantillons de sang ont été prélevés au départ, avant de commencer les TPO.
Les contre-indications à la réalisation du TPO le jour même ont été évaluées et TPO et prélèvement sanguin ont été reportés dans les circonstances suivantes :
- vaccination ou corticostéroïdes systémiques (oraux, intramusculaires et intraveineux) au cours des 2 semaines précédentes,
- inhibiteurs de la pompe à protons, antihistaminiques de première génération (c.-à-d. hydroxyzine [Atarax], chlorphénamine, kétotifène) au cours des 3 jours précédents,
- antihistaminiques de deuxième génération (c.-à-d. cétirizine, loratadine, desloratadine) au cours des 3 jours précédents,
- antihistaminiques de troisième génération (c.-à-d. hydroxyzine [Atarax]) au cours des 3 jours précédents, cetirizine, loratadine, desloratadine et fexofenadine) au cours des 5 derniers jours,
- salbutamol inhalé/nébulisé, montelukast, nédocromil oral, cromoglycate oral au cours des dernières 24 heures.
Pour les comparaisons génomiques, les groupes de contrôle ont été tirés du projet 1000 génomes [9] (http://www.1000genomes.org ; ci-après dénommé 1000G). La population ibérique (IBS ; n = 107) a été utilisée comme groupe de contrôle pour les tests d’association dans la phase de découverte. Dans la phase de validation, les SNP et les gènes candidats ont fait l’objet de tests supplémentaires à l’aide d’autres ensembles de données européens : CEU (n = 99), TSI (n = 111), GBR (n = 100) et un ensemble de données européennes fusionnées (combinant IBS, CEU, TSI et GBR ; n = 417).
Résultats
- 41 patients souffrant de SEIPA aiguës ont été recrutés, confirmés par un TPO standardisé à l’aliment coupable.
- Après exclusion de trois échantillons présentant un fond génétique d’ascendance non européenne, un total de 38 échantillons a été inclus pour l’analyse en aval.
- La cohorte finale comprenait 15 femmes et 23 hommes (âge médian de 62,5 mois).
- Le TPO a permis de classer les patients dans les catégories suivantes : phénotype sévère, modéré et léger. Il convient de noter que la plupart des réactions ont été déclenchées par le poisson (55,3 %), bien que la cohorte comprenne également une proportion significative de cas de SEIPA liés à d’autres causes principales de SEIPA telles que le lait de vache (18,4 %) et l’œuf (18,4 %).
- D’autres comorbidités allergiques ont été rapportées dans des proportions différentes pour la cohorte de SEIPA, la dermatite atopique (24%), l’asthme (21%) et l’allergie alimentaire à médiation IgE (18%) étant les affections coexistantes les plus courantes.
- En outre, une proportion remarquable de patients avait des antécédents familiaux de maladies allergiques (50 %).
- Enfin, une augmentation significative du nombre de neutrophiles a été détectée au TPO pour la plupart des patients (84%), ce qui est conforme aux observations précédentes chez les patients SEIPA.
Il a été mené une étude pionnière d’association cas-témoins à l’échelle de l’exome pour comprendre la base génétique du syndrome SEIPA. Ils ont identifié différents SNP et gènes candidats statistiquement associés au SEIPA.
DGKZ
- La protéine codée par DGKZ appartient à la famille des diacyl-glycérol kinases eucaryotes.
- DGKZ favorise la signalisation du facteur de croissance transformant β (TGF-β) ;
- Le TGF-β est une cytokine tolérogène clé qui régule l’intégrité de la barrière épithéliale intestinale en maintenant et en restaurant la fonction de barrière des entérocytes et en régulant la production d’IgA.
- Le TGF-β et les IgA sont essentiels pour induire des réponses tolérogènes par immunothérapie spécifique aux allergènes inhalés.
- Les enfants SEIPA au lait de vache ont montré des réponses déficientes en TGF-β lors de la stimulation par la caséine des cellules mononucléées du sang périphérique et des taux sériques d’IgA spécifiques à la caséine plus faibles par rapport aux enfants tolérants au lait.
- De plus, une expression réduite du récepteur TGF-β de type I a été rapportée sur les cellules épithéliales et mononucléées de la lamina propria des biopsies duodénales.
RBM8A
- Les défauts de la barrière épithéliale résultant des mutations FLG sont un facteur de risque majeur de développement de l’eczéma atopique, d’une allergie alimentaire médiée par les IgE, de l’asthme associé à l’eczéma et de la rhinite allergique.
- Il existe une relation significative entre les modèles de coexpression à l’échelle du génome FLG et RBM8A.
- Cela peut indiquer un lien fonctionnel entre les deux gènes grâce à l’existence de groupes de gènes.
- Le lien fonctionnel entre RBM8A et FPIES pourrait indiquer des mécanismes pathogènes communs liés à l’allergie alimentaire médiée par les IgE.
- Le gène RBM8A est associé à l’allergie au lait de vache.
ATG16L1
- ATG16L1 s’est avéré associé à une maladie inflammatoire de l’intestin (MII).
- ATG16L1 est impliqué dans l’autophagie, un processus cellulaire complexe crucial pour l’homéostasie intestinale, dérégulé dans les MII.
- Les MII ont été associées aux SEIPA chez les adultes.
- Un défaut de la fonction barrière et une dérégulation immunitaire sont essentiels à la physiopathologie des MII, et la maladie de Crohn est associée à une augmentation de la réponse Th17, la signature des SEIPA.
SIRPA
- SIRPA est un récepteur immunoinhibiteur principalement exprimé par la lignée myéloïde des cellules immunitaires, notamment les neutrophiles, les monocytes, les macrophages et les cellules dendritiques.
- De nombreuses publications proposent une association entre les signatures génétiques élevées des monocytes et des neutrophiles et les MII .
- SIRPA, comme d’autres gènes associés aux neutrophiles/monocytes, présente une régulation positive dans les tissus enflammés, probablement en raison de la présence d’un nombre accru de neutrophiles/monocytes exprimant la protéine SIRPα.
- Bien que la physiopathologie des SEIPA reste incomplètement élucidée, les réactions aiguës du SEIPA impliquent une profonde activation immunitaire innée, notamment les neutrophiles, les monocytes, les éosinophiles et les lymphocytes.
- Une augmentation des neutrophiles et une diminution du nombre d’éosinophiles et de lymphocytes dans le sang périphérique ont été rapportées, ce qui pourrait suggérer une migration de ce type de cellules vers le tissu intestinal.
- La dérégulation immunitaire innée via le SIRPA pourrait être un nouveau facteur potentiel contribuant à ce tableau.
Conclusion
- La génétique des SEIPA révèle des variantes significatives et des gènes associés, en particulier DGKZ, RBM8A, SIRPA et ATG16L1
- Les gènes candidats sont associés à la signalisation TGF-β, au syndrome TAR, à l’augmentation des neutrophiles/monocytes dans les tissus enflammés et aux MICI
- Les voies impliquées dans la pathophysiologie des SEIPA sont liées au dysfonctionnement de la barrière épithéliale et à la dysrégulation immunitaire.
Les syndromes d’entérocolites aigus aux protéines alimentaires (SEIPA) sont ils des allergies alimentaires ?
Oui, bien sûr.
Il s’agit de réactions immunitaires spécifiques d’un produit, l’affaire est entendue.
Non, évidemment.
Nous ne savons que peu de choses de leur mécanismes immuns. Ils semblent faire appel à l’immunité innée et nous avons appris dans nos livres que celle-ci n’est pas spécifique. Cette étude montre en plus que ce serait davantage une dysrégulation à prédisposition génétique alors non bien sûr ce n’est pas une allergie alimentaire.
Et "peut-être", ça marche "peut-être" ?
- Les dysrégulations d’origine génétique prédisposent aux allergies : la dermatite atopique fait le nid des allergies et l’inflammation allergique expérimentalement induite par l’oeuf inhalé chez la souris entraîne…une dermatite atopique…
- L’immunité innée est parfois spécifique, c’est ce que les dernières publications d’immunologie rapportent ces dernières années et notre dichotomie bien pratique ne s’avère plus si évidente.
Soyons donc ouverts d’esprit : les SEIPA sont une forme d’allergie alimentaire mal comprise qui semble impliquer une immunité innée spécifique associée, cet article le démontre, à des facteurs génétiques prédisposants.
